
O Meio Essencial Mínimo (MEM) é uma modificação do Meio Basal de Eagle (BME). Foi desenvolvido por Harry Eagle para atender às necessidades nutricionais específicas de certos subtipos de células HeLa e de fibroblastos mamíferos normais. MEM inclui maior concentração de aminoácidos de modo a aproximar da composição de proteínas requeridas pelas células de mamíferos cultivadas. O meio MEM apresenta diferentes variações trais como a incorporação de sais de Earle ou sais de Hank e pode ser adicionalmente complementado com aminoácidos não essenciais ácidos (NEAA). Este meio pode ser modificado eliminando o cálcio para facilitar o crescimento celular em suspensão.

O Meio Dulbecco’s Modified Eagle Medium (DMEM) é uma modificação do meio Eagle Basal (BME) que contém quatro vezes a concentração de aminoácidos e vitaminas. Além disso, a formulação também inclui glicina, serina e nitrato férrico. A formulação original contém 1000mg/L de glicose e foi originalmente usada para cultivar células de camundongos embrionários. MEM high glicose é uma modificação adicional do DMEM original e contém 4500mg/L de glicose. A glicose adicional provou ser útil no cultivo de várias outras linhas celulares, incluindo culturas primárias de células de camundongos e galinhas, bem como várias linhas celulares normais e transformadas. O mesmo meio pode ser suplementado e apresenta inúmeras variações.


Nós da Êxodo Cientifica, distribuidores Autorizados da marca HiMedia no Brasil possuímos em nosso catálogo muitas variações e apresentação dos meios MEM e DMEM (seja na forma desidratada para preparo em quantidades variadas [1L, 5L,10L, 20L e 50L] seja na forma líquida[embalagens de 100mL e 500mL individuais ou em packs com diferentes quantidades).
Consulte nos para maiores informações!
contato@exodocientifica.com.br
O cultivo celular animal (ATC) consiste nos processos de isolamento, propagação e manutenção de células de determinado tecido em um sistema in vitro. Este sistema é composto por elementos essenciais ao desenvolvimento e, também, é constituído por condições ambientais tais como, temperatura, pH, teor de CO2 etc. Todos estes elementos (nutricionais + fatores ambientais) são essenciais para a sobrevivência de tais estruturas celulares.
O cultivo celular animal teve seu desenvolvimento iniciado há mais de um século, onde, no ano de 1897, Leo Loeb (1869 – 1959) havia reconhecido os “princípios gerais” e importância do crescimento de células em ambiente artificial através de seu trabalho com tecidos embebidos em ágar ou coágulos de plasma e implantados em animais, foram a primeira tentativa registrada na literatura para o crescimento de tecidos de animais superiores sob condições artificiais em “ambientes que diferem daqueles encontrados no corpo sob condições naturais”.

Leo Loeb
Os primeiros meios de cultura desenvolvidos e usados com sucesso para o cultivo de células animais eram tipicamente compostos de plasma, soro, linfa ou extratos de tecidos. A natureza complexa e indefinida destes constituintes biológicos resultavam em uma grande variabilidade, levava ao aumento do risco de contaminação e impediu a elucidação dos nutrientes mínimos e específicos necessários para apoiar o crescimento das células nestes respectivos meios.
Ao desenvolver um novo método de cultura, sempre se enfrenta vários desafios. Um desses é realizar e garantir a manutenção das células e dos tecidos nos meios devido à grande discrepância entre a cinética celular in vivo e a cinética celular in vitro. A principal razão para tal, é a grande dificuldade em reproduzir um microambiente artificial em que as células se comportam como se estivessem em seu ambiente fisiológico natural.
Um microambiente artificial para células cultivadas é formado por vários fatores, incluindo citocinas, material de suporte, interações célula-célula e manutenção do estresse físico. Dado que vários fatores modulam o comportamento e a função das células cultivadas em condições normais. Células viáveis em condições patológicas são submetidas a combinações ainda mais aberrantes, ou seja, são adicionados ao meios mais toxinas, edemas, ascite e temperatura diferenciada. Esses fatores ambientais anormais levam à ativação de reações patológicas nas células in vivo. Pode-se ver, portanto, que é extremamente difícil reproduzir um microambiente anatômico ou fisiológico simplesmente recorrendo a um sistema de cultura convencional específico.
Por essas razões, muitos grupos de pesquisa procuraram desenvolver meios de cultura quimicamente definidos sem soro (serum-free) por meio da análise da composição celular dos elementos dos soros, onde se procurava mimetizar estes elementos nos meios de cultura, e através da identificação de componentes-chave necessários e essenciais para garantir o desenvolvimento das culturas.
O trabalho pioneiro realizado por Harry Eagle, culminou no desenvolvimento de uma formulação básica, que poderia suportar o crescimento de duas linhagens celulares diferentes, fibroblastos L de camundongo e células HeLa (carcinoma uterino humano).

Harry Eagle
O meio inicial de Eagle continha “uma mistura arbitrária de aminoácidos, vitaminas, cofatores, carboidratos e sais” junto com soro dialisado. Esse meio foi “batizado” de Essential Medium (MEM). O MEM é composto por 28 metabólitos essenciais que, quando suplementados com soro, podem suportar a propagação de uma ampla variedade de linhagens celulares com tempos de duplicação de 18 a 24 h. Embora este meio contenha soro em sua composição, sua formulação ainda é a base para muitos meios de cultura de células amplamente usados até hoje. Como exemplo, o DMEM (Dulbecco’s Modified Eagle Medium) de Dulbecco e Freeman foi resultante de uma versão modificada do meio de Eagle contendo uma concentração quatro vezes maior de aminoácidos e vitaminas em relação ao MEM. Esta formulação demonstrou suportar crescimento aprimorado e densidades celulares mais altas em relação ao MEM e acabou sendo usado como base para várias formulações de meios isentos de soro.

A mistura de nutrientes de Ham F12, foi um exemplo inicial bem-sucedido de um meio de cultura totalmente sintético, quimicamente definido e livre de soro que poderia suportar o crescimento clonal de células de ovário de hamster chinês (CHO- Chinese Hamster Ovary). Este meio (Nutriente Mixture F12- Ham) foi projetado para o cultivo e expansão de células únicas, mas não era adequado para suportar o crescimento de altas densidades celulares (superiores a 105 células por ml).
Sato et al. determinaram posteriormente que essa deficiência poderia ser remediada pela mistura do F12- Ham com o meio de Dulbecco, além da suplementação com hormônios, fatores de crescimento e transferrina, resultando assim em uma nova formulação chamada DMEM/F12 (Dulbecco’s Modified Eagle Medium/ Nutrient Mixture F-12 Ham). Nesta nova composição, Hiroki Murakami et al. identificaram quatro aditivos críticos necessários para a reposição do soro em meios quimicamente definidos: insulina, transferrina, etanolamina e selênio. Combinados, esses quatro aditivos formaram um suplemento (ITES), que foi usado como componente quimicamente definido para substituição do soro. Além disso, a equipe de Murakami melhorou mais os meios existentes misturando formulações já conhecidas, como DMEM/F12 com outras como o RPMI-1640.
Os meios RPMI são uma série de meios desenvolvidos por Moore et al para a cultura de células normais e neoplásicas humanas in vitro. O meio RPMI-1640, por sua vez, é um meio de cultura de células proposto pelo Roswell Park Memorial Institute (Buffalo, NY) que resultou na cultura bem-sucedida de linfócitos humanos.
A mistura do RPMI com o DMEM/F12 juntamente com o suplemento ITES como substituto da remoção do soro, gerou o meio RDF basal e, posteriormente, o RDF enriquecido (eRDF).
Yap et al. avaliaram ainda mais o papel de metais traços em meios de cultura de células sem soro, identificando atividades miméticas à insulina mediadas sobre as culturas através do zinco, o que levou sua demonstração como substituto de insulina em meios quimicamente definidos e isentos de proteínas.
A seguinte tabela apresenta a composição de diferentes meios de cultura clássicos destinados ao cultivo animal.
| Componentes (mg/L) | BME (Eagle 1955) | MEM (Minimum Essential Media) (Eagle, 1959) | F12 (Ham, 1965) | DMEM/F12 (Barnes, 1979) | eRDF (Murakami, 1989) | |
| Aminoácidos | Glycine | 7.51 | 3.76 | 42.8 | ||
| L-Alanine | 8.91 | 4.46 | 6.68 | |||
| L-Arginine | 17.42 | 105 | 210 | |||
| L-Arginine HCl | 210.7 | 105.4 | 581.5 | |||
| L-Asparagine | 13.21 | 6.61 | ||||
| L-Asparagine Monohydrate | 94.5 | |||||
| L-Aspartic acid | 13.31 | 6.66 | 39.9 | |||
| L-Cystine | 12.015 | 24 | 48 | |||
| L-Cysteine HCl | 31.52 | 15.76 | ||||
| L-Cysteine HCl H2O | 105.4 | |||||
| L-Glutamic Acid | 14.71 | 7.36 | 39.7 | |||
| L-Glutamine | 292.2 | 292 | 146.1 | 657 | 1000 | |
| L-Histidine HCl H2O | 75.4 | |||||
| L-Histidine HCl | 19.16 | 9.58 | ||||
| L-Histidine | 7.76 | 31 | 62.0 | |||
| L-Hydroxyproline | 31.5 | |||||
| L-Isoleucine | 26.24 | 52 | 3.94 | 105.97 | 157.4 | |
| L-Leucine | 26.24 | 52 | 13.12 | 110.56 | 165.3 | |
| L-Lysine HCl | 36.52 | 18.26 | 197.2 | |||
| L-Lysine | 29.24 | 58 | 116 | |||
| L-Methionine | 7.46 | 15 | 4.48 | 32.24 | 49.2 | |
| L-Phenylalanine | 16.52 | 32 | 4.96 | 66.48 | 74.3 | |
| L-Proline | 34.53 | 17.27 | 55.2 | |||
| L-Serine | 10.51 | 5.26 | 85.1 | |||
| L-Threonine | 23.82 | 48 | 11.91 | 101.96 | 110.8 | |
| L-Tryptophan | 4.084 | 10 | 2.042 | 21.02 | 18.4 | |
| L-Tyrosine | 18.12 | 36 | 5.44 | 74.72 | 87.0 | |
| L-Valine | 23.44 | 46 | 11.72 | 97.86 | 109.0 | |
| Sais Minerais | Calcium Chloride Dihydrate | 44.10 | 22.05 | 108.77 | ||
| Calcium Chloride | 111 | 200 (0 for suspension culture) | ||||
| Magnesium Chloride | 47.6 | |||||
| Magnesium Chloride Hexahydrate | 200 | 121.98 | 161 | |||
| Magnesium Sulfate, Anhydrous | 66.22 | |||||
| Potassium Chloride | 373 | 400 | 223.8 | 311.9 | 373 | |
| Sodium Bicarbonate | 1680 | 2000 | 1176 | 2788 | 1050 | |
| Sodium Chloride | 5840 | 6800 | 7592 | 7196 | 6424 | |
| Sodium Phosphate Monobasic Dihydrate | 150 (1500 for suspension culture) | 750 | ||||
| Sodium Phosphate Monobasic Monohydrate | 138 | |||||
| Sodium Phosphate Dibasic heptahydrate | 268.1 | 134.1 | ||||
| Sodium Phosphate Dibasic Dodecahydrate | 6593 | |||||
| Elementos Traços | Cupric Sulfate Pentahydrate | 0.002497 | 0.001249 | 0.000749 | ||
| Sodium Selenite | 0.001729 | |||||
| Ferrous Sulfate Heptahydrate | 0.834 | 0.417 | 0.222 | |||
| Zinc Sulfate Heptahydrate | 0.8625 | 0.432 | 0.23 | |||
| Vitaminas | Biotin | 0.2443 | 0.007329 | 0.003665 | 0.1 | |
| Choline Chloride | 13.96 | 6.98 | 12.29 | |||
| Choline | 0.1042 | 1 | 2 | |||
| Pantothenate | 0.2190 | 1 | 2 | |||
| D-Calcium Pantothenate | 0.4765 | 0.24 | 1.24 | |||
| Folic Acid | 0.4414 | 1 | 13.242 | 2.66 | 1.81 | |
| Niacinamide | 0.1221 | 1 | 0.03663 | 2.02 | 1.47 | |
| p-Aminobenzoic Acid | 0.51 | |||||
| Pyridoxal HCl | 1 | |||||
| Pyridoxal | 0.1672 | 1 | 2 | |||
| Pyridoxine HCl | 0.06169 | 0.03085 | 0.51 | |||
| Riboflavin | 0.03764 | 0.1 | 0.03764 | 0.22 | 0.21 | |
| Thiamine | 0.2654 | 1 | 2 | |||
| Thiamine HCl | 0.3373 | 0.1687 | 1.59 | |||
| Vitamin B12 | 13.554 | 0.68 | 0.34 | |||
| Poliamina | Putrescine 2HCl | 0.1611 | 0.08 | 0.040 | ||
| Fatores de Crescimento | DL-α-Lipoic Acid | 0.2063 | 0.103 | 0.0516 | ||
| i-Inositol | 2 | 18.02 | 13.01 | 46.85 | ||
| Acidos Graxos | Linoleic Acid | 0.08412 | 0.04206 | 0.02103 | ||
| Outros | HEPE | 3574.5 | 1190 | |||
| D-(+)-Glucose | 901 | 1000 | 1802 | 1401 | 3423 | |
| Hypoxanthine | 4.083 | 2.04 | 1.02 | |||
| L-Glutathione, Reduced | 0.49 | |||||
| Phenol Red | 5 | |||||
| Sodium Pyruvate | 110 | 55 | 110 | |||
| Thymidine | 0.7266 | 0.3633 | 5.72 | |||
| Aditivo | 5-10% of serum, plus antibiotics | 5-10% of serum | 5-10% of serum plus Phenol Red | Serum and antibiotics | serum-free |
Usualmente os meios destinados para o cultivo celular animal são preparados a partir do meio desidratado que é reconstituído em água, filtrado em membrana e adicionado os devidos suplementos (nutrientes, antibióticos, fatores de crescimento etc.) ou frequentemente se utiliza dos meios já prontos para o uso.
Nós da Êxodo Científica, distribuidores autorizados da marca HiMedia no Brasil possuímos um dos maiores e mais amplo portfólio apresentando grande variedade e opções de meios clássicos, suas variações e muitos outros materiais destinados para o cultivo celular animal.
Consulte nossa equipe para maiores informações!
contato@exodocientifica.com.br
Referências:
– Ritacco, F.V., Wu, Y. and Khetan, A. (2018), Cell culture media for recombinant protein expression in Chinese hamster ovary (CHO) cells: History, key components, and optimization strategies. Biotechnol Progress, 34: 1407-1426. https://doi.org/10.1002/btpr.2706.
– Aoki, S., Takezawa, T., Sugihara, H., and Toda, S. (2016) Progress in cell culture systems for pathological research. Pathology International, 66: 554– 562. doi: 10.1111/pin.12443.
– Baust, J.M., Buehring, G.C., Campbell, L. et al. Best practices in cell culture: an overview. In Vitro Cell.Dev.Biol.-Animal 53, 669–672 (2017). https://doi.org/10.1007/s11626-017-0177-7
-Loeb, L. (1978), On transplantation of tumors. CA: A Cancer Journal for Clinicians, 28: 369-374. https://doi.org/10.3322/canjclin.28.6.369
-Fangerau H. Front Cell Dev Biol. 2022 Feb 14;9:801333. doi: 10.3389/fcell.2021.801333. eCollection 2021.
– Lee S, Kim BY, Yeo JE, Nemeno JG, Jo YH, Yang W, Nam BM, Namoto S, Tanaka S, Sato M, Lee KM, Hwang HS, Lee JI.Transplant Proc. 2013 Oct;45(8):3108-12. doi: 10.1016/j.transproceed.2013.08.013.
Conheça os meios:

O gênero Rhizobium e demais microrganismos nodulantes são capazes de formar relações simbióticas complexas com plantas leguminosas.
Nesta relação, as bactérias colonizam as raízes das plantas e induzem a formação de estruturas especializadas chamadas nódulos.
Nos nódulos, as bactérias se multiplicam, formam células especializadas chamadas bacteroides e, posteriormente, convertem o nitrogênio atmosférico em amônia.

A energia para a redução do nitrogênio é fornecida pela planta, através fotossíntese e o produto resultante fornece uma fonte de nitrogênio para a planta.
Formulações disponíveis:

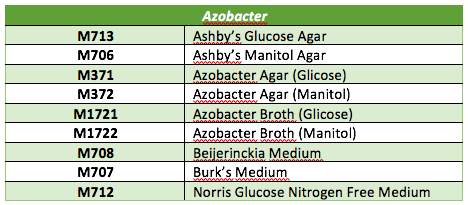
Azotobacter é uma bactéria fixadora de nitrogênio de vida livre.
É utilizada como biofertilizante no cultivo.
A planta precisa de nitrogênio para seu crescimento e Azotobacter fixa o nitrogênio atmosférico de forma não simbiótica. Portanto, todas as plantas, árvores, vegetais, são beneficiados. Além deste aproveitamento, Azotobacter é usado como modelo em aplicações biotecnológicas como uso para produção de alginato e para produção de nitrogênio em bateladas.

Formulações disponíveis:
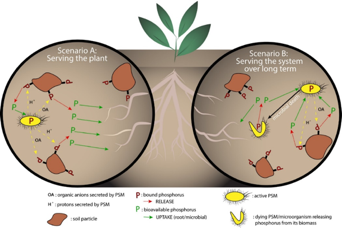
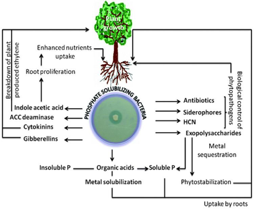
Os microrganismos solubilizadores de sais convertem os respectivos sais insolúveis no solo em uma forma em que as plantas conseguem assimilá-los
Bactérias solubilizadoras exercem efeitos benéficos no crescimento de diversas culturas tais como algodão, pimenta e pepino, sorgo, trigo etc.
Portanto, as bactérias solubilizadoras são amplamente utilizados como biofertilizantes.

Formulações disponíveis:

Clique aqui para fazer download da Lista Completa
Para te auxiliar a identificar o produto mais adequado á sua aplicação, entre em contato com nossa assessoria científica. microbiologia@exodocientifica.com.br
Suplementos para meio listeria oataviani -agosti agar (aloa) para listeria.


O gênero Listeria vem sendo revisado nos últimos anos e atualmente conta com 20 espécies (anteriormente eram conhecidas apenas 6 espécies).

Tabela: Espécies do gênero Listeria (Nwaiwu, Access Microbiology 2020;2 / DOI 10.1099/acmi.0.000153)
Dentre as espécies de Listeria, a L. monocytogenes representam a mais patogênica dentre as demais representantes do gênero.
Existem diferentes metodologias e padronizações para o isolamento e identificação das espécies de Listeria. Um meio de cultura muito utilizado e reportado nestas metodologias é o meio de cultura seletivo e diferencial Ottaviani-Agosti também chamado de ALOA ou OA Listeria Agar.
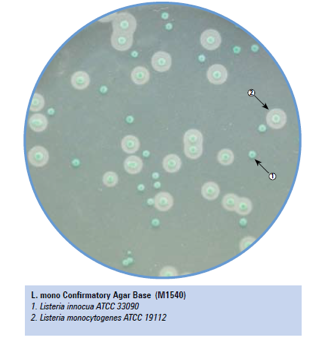
Este meio de cultura possui em sua composição peptona, triptona e extrato de levedura que fornecem compostos nitrogenados, carbonáceos, aminoácidos de cadeia longa, vitaminas e outros nutrientes essenciais. O piruvato de sódio fornece nutrientes essenciais para o desenvolvimento de Listeria. A glicose (Dextrose) é o açúcar fermentável. O cloreto de sódio mantém o equilíbrio osmótico. O fosfato tampona o meio.
O meio possui também o substrato cromogênico 5-Bromo-4 cloro-3-indolil-β−D-glucopiranosideo, que é hidrolisado especificamente por Listeria spp. Resultando em colônias com a coloração azul esverdeada.
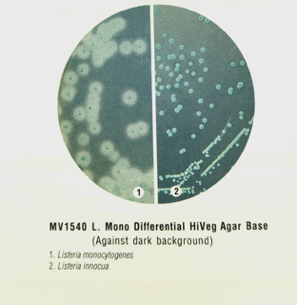
A seletividade do meio se dá pela adição do cloreto de lítio (presente no meio desidratado) e de outros agentes seletivos a serem adicionados após o processo de esterilização do meio base.


Tais agentes seletivos a serem adicionados são os suplementos
O meio Ottaviani e Agosti também deve ser suplementado com o L- fosfatidilinositol (suplemento FD214): L.mono Enrichment Supplement I.
A completa identificação de Listeria spp se baseia na realização de outras provas bioquímicas para distinção dentre as espécies.
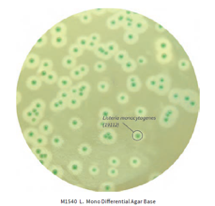
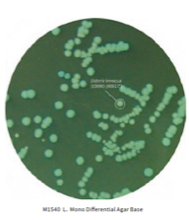

Nós da Exodo Científica, possuímos À PRONTA ENTREGA tanto o meio base Ottaviani-Agosti e todos os suplementos necessários para a produção do meio completo conforme ISO 11290-1: 2017 (NBR ABNT ISO 11290-1: 2020) e ISO 11290-2: 2017 (ABNT NBR ISO 11290-2 : 2020).

Consulte-nos para maiores informações
microbiologia@exodocientífica.com.br
Reagente utilizado na DETERMINAÇÃO DE BORO pelo método espectrofotométrico proposto por CAPELLE em 1961. (Em solução aquosa, a azometina-H se dissocia em ácido 4-amino-5-hidroxi2,7-naftalenodissulfônico e aldeído salicílico. É formado um quelato de borato com a azometina-H que em combrimento de onde de 420nm permite-se obter a quantificação do elemento boro.
Amplamente utilizada em análises de solos, águas naturais e de plantas.
O uso para a determinação de Boro fazendo uso da Azometina-H deve-se à utilização do meio reacional aquoso, tornando-o mais simples e mais sensível, à medida que é comparado com outros métodos colorimétricos. A Azometina H não possui interferência da maioria dos íons presentes em extratos de solos e plantas e utilizados na composição dos fertilizantes. (WOLF,1971).
Compre em:
contato@exodocientifica.com.br
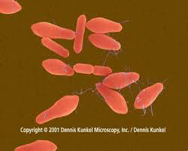
O microrganismo Gram Positivo Clostridium perfringens é amplamente reconhecido como sendo um valioso indicador de contaminação fecal em amostras de água.
Esses microrganismos formam esporos que são formas resistentes ao aquecimento em comparação com as células vegetativas. Os esporos de C. perfringens sobrevivem na água por meses, muito mais tempo que as demais bactérias indicadoras fecais vegetativas e, consequentemente, sua presença pode indicar poluição fecal remota ou intermitente.
Eletromicrofotografia de varredura (colorida artificialmente) de cepas de Clostridium perfrinfens
O monitoramento de C. perfringens tem se mostrado útil para a avaliação da qualidade dos recursos hídricos e para verificar as etapas do tratamento da água para avaliar o desempenho das obras de tratamento. Nem sempre os esporos de C. perfringens são inativados por procedimentos de desinfecção de comumente empregados (por exemplo, cloração).
A ISO 14189:2013 trata da enumeração de Clostridium perfringens utilizando o método por filtração em membrana (membrana filtrante). Este método foi desenvolvido para amostras de água destinada ao consumo humano. Porém, pode ser aplicado a todos os tipos de amostras de água, desde que não contenham partículas ou matéria coloidal que interfira com a filtração.
Dependendo da amostra (se a intenção for contar somente esporos) aquecer a amostra a 60±2°C em banho de água por 15±1 minutos
É utilizado membrana com poro de tamanho 0,45µm que é capaz de reter esporos de clostridia. A membrana é incubada sobre o meio TSC (triptose sulfito cicloserina ágar) anaerobicamente a 44±1 °C por 21±3 h.
Colônias características de Clostridium perfringens normalmente produzem colônias negras ou cinzas a marrom amareladas decorrente da redução do sulfeto a sulfito que reagem com o metabissulfito de sódio e com o citrato férrico presente na composição do meio.


Meio TSC contendo Clostridium perfringens
Ao se encontrar colônias típicas, estas são contadas e devem ser confirmadas. A confirmação se dá pela determinação da fosfatase ácida. Esta determinação é realizada através do uso do Reagente Fosfatase Ácida (R096 https://himedialabs.com/TD/r096.pdf).
A fosfatase ácida produzida por C. perfringens catalisa a hidrólise do α-naphthylphosphate , ocorrendo a liberação de α- naftol e fosfato formando que forma um corante azo com diazônio o-dianisidina, que possui uma forte absorbância a 405 nm. O aumento da absorbância é diretamente proporcional ao nível da enzima fosfatase ácida.
O resultado positivo para a fosfatase ácida resulta como a formação de uma cor púrpura forte ocorrendo entre 3-4 minutos após a adição do reagente.

Teste Fosfatase Ácida Positivo

Teste Fosfatase Ácida Negativo
Durante o preparo da amostra (realização do pré-aquecimento quando necessário), o tempo para atingir a temperatura 60±2°C não deve ultrapassar os 15 minutos. Este procedimento pode ser otimizado fazendo com que a água no banho-maria circule para maximizar a troca de calor
Após o crescimento de colônias típicas no meio TSC, as mesmas devem ser subcultivadas anaerobicamente por 21±3 horas a 36±2 °C em meio não seletivo (Ágar sangue ou Ágar Columbia Base ou Agar TSA).
Sobre o Reagente de fosfatase ácida:
– Quando em repouso pode-se formar um precipitado. Neste caso, o reagente pode ser filtrado e o reagente utilizado normalmente para teste.
– Devido à composição do produto, pode ocorrer a formação de espuma o que não afetará os critérios de desempenho do reagente
Nós da Êxodo Científica possuímos todos os meios de cultura necessários para o Isolamento de Clostridium conforme a ISO 14189.
O reagente de Fosfatase Ácida (R096) como possui a validade mais restrita (5 meses a partir da fabricação) atendemos a comercialização deste item através de importação sob demanda para que possamos oferecer o produto com a maior validade possível).
Consulte-nos para maiores informações!!!
microbiologia@exodocientifica.com.br
TBX Ágar (Triptone Bile Glucoronic Agar) À PRONTA ENTREGA!!!
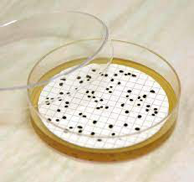
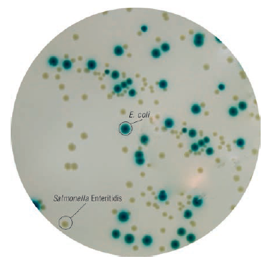
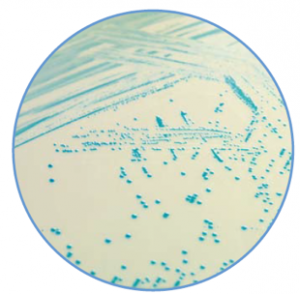
O Ágar TBX (Triptone Bile Glucoronic Agar) é um ágar seletivo para a detecção e contagem de Escherichia coli em alimentos, ração animal e amostras clínicas.
A formulação do TBX Ágar (Triptone Bile Glucoronic Agar) é baseado na metabolização do substrato cromogênico 5-bromo-4-cloro-3-indolil-ß-D-glucuronídeo.
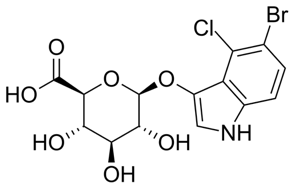
5-bromo-4-cloro-3-indolil-ß-D-glucuronídeo
O ágar contém a o substrato X- glucoronídeo que diferencia a maioria das espécies de E. coli de outros coliformes. As células de E. coli absorvem o cromógeno X-Glucoronideo e a enzima glucuronidase intracelular hidrolisa a ligação entre o cromóforo e o açúcar conjugado. O cromóforo liberado dá coloração verde azulada para as colônias de E. coli.
O crescimento da flora gram positiva acompanhante é amplamente inibido pelo uso de sais biliares e à alta temperatura de incubação a 44 ° C
Este meio de cultura está de acordo e atende os requisitos da ISO 16649:2018 Partes 1, 2 e 3.
Solicite agora mesmo:
contato@exodocientifica.com.br
Os sais derivados de tetraetilamonio (TEA), (NEt+4) or (Et4N+) é constituído de um grupamento amônia quartenária e possui quatro grupos etil ligados ao átomo de nitrogênio central. É carregado positivamente.
É um componente usado no laboratório na preparação de sais lipofílicos de ânions inorgânicos. É usado de forma semelhante ao tetrabutilamônio, com a diferença de que seus sais são menos lipofílicos e mais facilmente cristalizados.
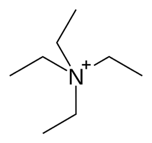
A principal característica química dos sais de tetraetilamônio é sua capacidade de se envolver em processos que envolvem transferência de fase como exemplo os mecanismos de catálise de transferência de fase.
O uso mais comum de tetraetilamônio, é como um agente de pesquisa farmacológica em estudos que envolvem o bloqueio de canais seletivos de potássio.
Nós da Exodo Científica possuímos diferentes sais de tetraetilamônio e suas respectivas soluções à pronta entrega.
Consulte nossa equipe para maiores informações!

© Copyright 2015 - 2024 - Êxodo Científica. Todos os direitos reservados.
Desenvolvido por Êxodo Científica