
ÁGUA POTABILIDADE
PORTARIA GM/MS N°888, DE 4 DE MAIO DE 2021
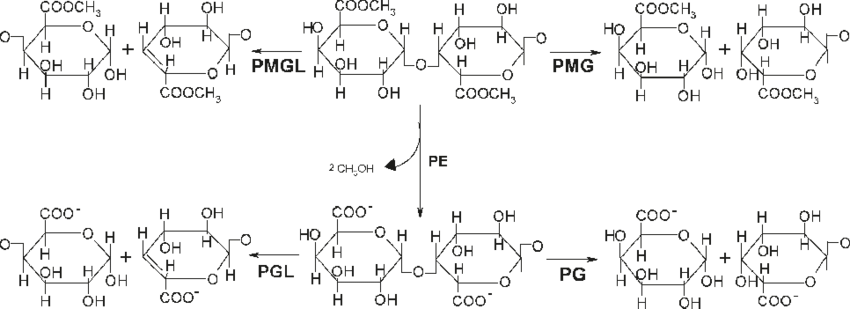
PESQUISA DE ENDOSPOROS BACTERIANOS EM AMOSTRAS DE ÁGUA

Recentemente foi lançada a portaria PORTARIA GM/MS N°888, DE 4 DE MAIO DE 2021 alterando o Anexo XX da Portaria de Consolidação nº 5, de 28 de setembro de 2017.
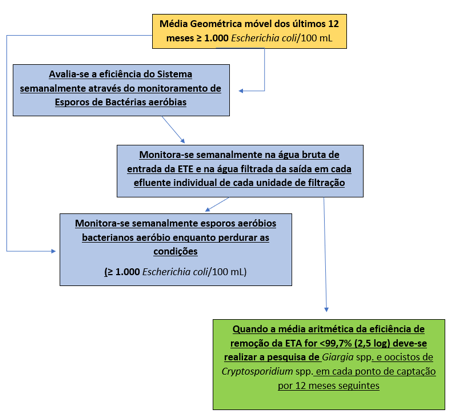
Dentre os parâmetros que foram incluídos nesta nova Portaria a deve-se realizar o monitoramento semanal de esporos de bactérias aeróbias a fim de avaliar a eficiência de remoção da Estação de Tratamento de Água (ETA). Sendo que, esta análise deve ser feita na água bruta da entrada e no efluente individual de cada unidade de filtração saída da ETE.
Esta análise deve ser realizada semanalmente.
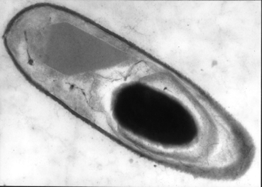
Os endosporos são estruturas dormentes e ambientalmente resistentes formada por certos gêneros de bactérias. A maioria dos microrganismos aeróbios formadores de esporos são organismos saprofíticos inofensivos encontrado no solo e na água.

As células vegetativas dos microrganismos aeróbios formadores de esporos eporulam em resposta de condições adversas do ambiente externo.
A bactéria pode persistir na forma de endósporo (estruturas, cuja função é proporcionar resistência e garantir a sobrevivência do organismo em ambiente inadequado por um período prolongado).
Em condições favoráveis, como por exemplo um ambiente que proporciona o fornecimento de nutrientes disponíveis, os endosporos retornam à sua forma vegetativa. Este processo é chamado de germinação.
Diferente do estado vegetativo, os endósporos resistem às adversidades ambientais, como calor, dessecação, desinfecção e irradiação.
Os endosporos aeróbicos que ocorrem na água são pesquisados a fim de avaliar a eficiência de remoção da Estação de Tratamento de água (ETA).
A análise de endosporos aeróbicos pode ser usada para avaliar um variedade de processos de tratamento de água, incluindo remoção física processos (por exemplo, coagulação, clarificação) e desinfecção.
A maioria das fontes de águas superficiais (exceto alguns lagos e reservatórios) contêm níveis suficientes de endosporos que são avaliados para determinar a eficiências de remoção destes.
Os endosporos são microrganismos indicadores da eficiência da ETA devido suas estruturas resistentes que precisam de uma condição mais “agressiva” para ser eliminado.
Os endosporos também são usados para determinar a eficácia de processos tais como a adição de halogênio, ozônio e inativação por luz ultravioleta.
O procedimento também foi usado para avaliar a eficácia da infiltração das margens do rio. Além disso, a presença de endosporos podem ser usados para determinar a integridade física de sistemas de distribuição de água potável que podem ter sido comprometidos por meio de quebras de tubulação ou procedimentos de manutenção.
Outra grande importância da pesquisa de endosporos bacterianos servem como parâmetro para o início e acompanhamento dos monitoramentos de Cryptosporidium e Giargia.
ENDOSPOROS BACTERIANOS
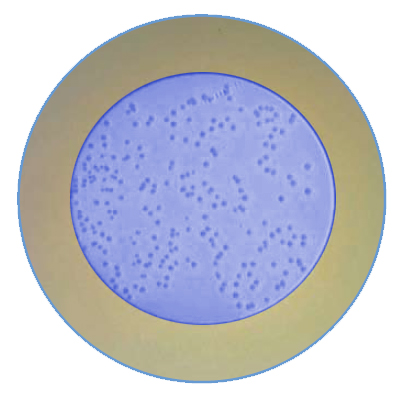
O Standard Methods for the Examination of Water and Wastewater (23ª Edição) descreve a metodologia pela técnica de Membrana Filtrante (9218 B) para a detecção e contagem de Endosporos Bacterianos.
O MEIO DE CULTURA EMPREGADO PARA ESTA FINALIDADE É O ÁGAR NUTRIENTE COM AZUL DE TRIPAN (CÓDIGO M2051)
https://himedialabs.com/TD/M2051.pdf

A composição e desempenho deste meio segue o descrito no Standard Methods.
A amostra antes de ser analisada deve ser tratada sob aquecimento para que ocorra a eliminação das formas vegetativas presentes. Desta forma ficará remanescente somente as formas esporuladas.
A amostra é filtrada em membrana filtrante 0,45µm e a membrana é submetida no meio de cultura.
Incubar por 35°C ±0,5 por 24 h ± 2.
Algumas colônias requerem incubação adicional de 5-7 dias para a formação de endosporos.
A presença do Azul de Tripan (tripano) neste meio garante uma coloração de fundo na membrana.
Considerar qualquer colônia presente na membrana que seja catalase positiva como sendo bactéria aeróbia formadora de esporo.
Produtos À PRONTA ENTREGA!!!!
Entre em contato conosco:
contato@exodocientifica.com.br
MEIOS CROMOGÊNICOS PARA Listeria spp. À PRONTA ENTREGA!
O gênero Listeria vem sendo revisado nos últimos anos e atualmente conta com 20 espécies (anteriormente eram conhecidas apenas 6 espécies).

Figura 1: Espécies de Listeria com as respectivas datas de descobertas. (Fonte: NWAIWU, 2020).
Dentre as espécies de Listeria, L. monocytogenes e L. ivanovii são patogênicos para camundongos e outros animais. No entanto, apenas L. monocytogenes está comumente associada à listeriose humana. A infecção associada à listeriose por L. ivanovii, e mesmo por L. seeligeri, é extremamente rara em humanos (LESSING et al. 1994).
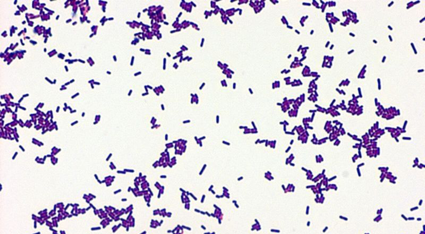
Listeria é uma bactéria ubíqua (encontrada em diversos ambientes tais como solo, água, superfícies, alimentos etc.). A infecção por Listeria é denominada de listeriose. Os seres humanos adquirem Listeria através da ingestão de alimentos contaminados por este microrganismo que possui a capacidade de penetrar através do trato intestinal causando infecções sistêmicas tais como: meningite, encefalite, septicemia, em mulheres grávidas pode provocar tanto aborto quanto parto prematuro ou ocorrência de natimorto.
Listeria monocytogenes é responsável por casos isolados e por surtos de listeriose em humanos e em animais. Foi identificada e reconhecida como agente patogénico para animais em 1940. No entanto, só a partir dos anos 80, na sequência de vários surtos graves atribuídos ao consumo de alimentos contaminados com L. monocytogenes, esta bactéria passou a ser considerada uma ameaça para a saúde pública pela comunidade científica, pela indústria alimentar e pelos consumidores.
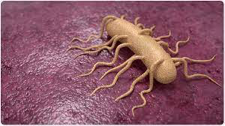
Em amostras clínicas, o isolamento e detecção de Listeria é realizado através da pesquisa do patógeno em amostras de sangue ou de líquor.
Já em alimentos, existe metodologias que averiguam tanto a pesquisa (presença e ausência) quanto a quantificação (em UFC ou NMP em determinado volume ou massa).
No Brasil, a determinação de Listeria em alimentos vêm ganhando importância, tal que nos parâmetros adotados atualmente (RESOLUÇÃO – RDC Nº 331, DE 23 DE DEZEMBRO DE 2019 e INSTRUÇÃO NORMATIVA N° 60, DE 23 DE DEZEMBRO DE 2019) a pesquisa de Listeria se torna obrigatória (salvo algumas exceções) em diversos alimentos prontos para o consumo.
Existem diferente metodologias padronizadas que tratam do isolamento, quantificação e identificação de Listeria monocytogenes e outras Listeria spp. Podemos citar: ISO 11290-1, ISO 11290-2, Compendium, BAM Capítulo 10, FSIS USDA.
Com o advento dos meios cromogênicos, muitas análises microbiológicas se tornaram processos mais rápidos e com uma maior especificidade, pois estes meios além de garantir o crescimento microbiano diante de suas necessidades nutricionais, estes mesmos meios partem do princípio da atuação de enzimas específicas dos microrganismos sobre os substratos (cromógenos) que, após metabolizados resultam em colônias apresentando cores específicas.
No caso das análises de Listeria alguns meios cromogênicos tornaram o processo de identificação presuntiva muito mais rápido e efetivo que as técnicas anteriormente empregadas do desenvolvimento dos meios cromogênicos.
Dentre os meios cromogênicos, nós da Êxodo Científica, distribuidores autorizados da marca Himedia possuímos opções à pronta entrega de diferentes meios cromogênicos (Linha HiCrome) para Listeria!
Certas bactérias possuem a citocromo oxidase ou indofenol oxidase (uma hemoproteína contendo ferro), que catalisa o transporte de elétrons de compostos doadores (NADH) para aceitadores de elétrons (normalmente o oxigênio).
No teste de oxidase, um corante incolor como o N, N-dimetil-p-fenilenodiamina tem a função de servir como um aceptor de elétrons artificial para a enzima oxidase.
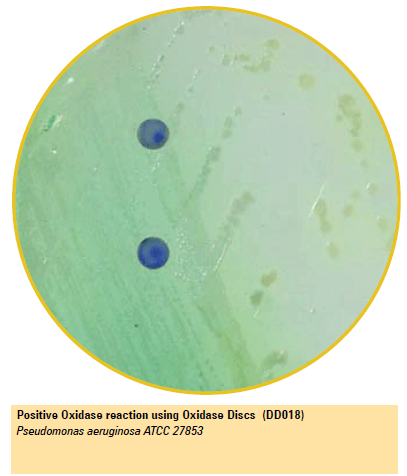
O corante é oxidado para formar o azul de indofenol (indophenol blue), que é um composto colorido.
O teste da oxidase é útil na caracterização inicial de bactérias aeróbias gram-negativas dos gêneros Aeromonas, Plesiomonas, Pseudomonas, Campylobacter e Pasteurella.
Os discos de oxidase são discos de papel de filtro estéreis impregnados com oxalato de N, N-dimetil-p-fenilenodiamina, ácido ascórbico e a-naftol. Esses discos superam a necessidade de preparação diária de reagente fresco para averiguação da oxidase.

Inicialmente o teste de oxidase foi introduzido por Gordon e McLeod (1) para identificar gonococos com base na capacidade de certas bactérias em produzir azul de indofenol a partir da oxidação de dimetil-p-fenilenodiamina e a-naftol. Gaby e Hadley posteriormente introduziram um método mais sensível usando N, Oxalato de N-dimetil-p-fenilenodiamina em que todos os estafilococos eram negativos para a oxidase.

O tempo de reação nos discos de oxidase de marca Himedia é de 5-10segundos! CADA VIAL CONTEM 50 DISCOS.
Você sabia?
Possuímos em nosso catálogo as seguintes enzimas da marca Himedia, muito empregadas em técnicas com cultura celular vegetal (obtenção de protoplastos, dissociação celular e testes enzimáticos).
Celulase
9012-54-8
Activity: ≥10 U/mg
Macerozima R-10
Activity : 3000 U/g
Pectinase
Activity : 8000 -12000 U/g
Pectoliase
Activity : ≥0.3 unit/mg

O Brasil ocupa uma posição de destaque entre os maiores produtores de alimentos do planeta e essa posição vem acompanhada cada vez mais em novas tecnologias e investimentos no setor. Um dos assuntos mais inovadores se trata do emprego de microrganismos como insumos biológicos capazes de desempenhar atividades benéficas e necessárias para o desenvolvimento das plantas. O emprego de algum microrganismo com esta finalidade é denominado de INOCULANTE.
Dentre alguns microrganismos empregados como inoculante podemos citar as bactérias do gênero Rizhobium , Azospirillum e Bacillus pois estes atuam sobre o crescimento e promoção das plantas, ajudam no processo de germinação em sementes e/ou no favorecimento do desenvolvimento de plântulas e acabam atuando também no crescimento de plantas.

Estes inoculantes desempenham papel primordial no ciclo do fósforo no solo, sendo capazes de transformar o fósforo insolúvel em formas solúveis e acessíveis às plantas. A adição de inoculantes contendo esses microrganismos aceleram o processo de liberação na rizosfera do fósforo inorgânico ou orgânico não disponíveis e enriquecem o solo biologicamente . Outros benefícios são a solubilização de K, produção de fitormônios, enzimas, compostos sideróforos, garantem proteção contra outros agentes patógenos e por meio de mecanismos secundários, aumentam a absorção de outros nutrientes e água pelo estímulo ao sistema de raízes.

Raíz de milho sem inoculante esquerda) e com inoculante (direita)
FONTE: https://revistapesquisa.fapesp.br/colaboracao-entre-planta-e-bacteria/
Dentre os microrganismos empregados como inoculantes, o gênero Bacillus (compreende microrganismos [bacilos] Gram positivos, catalase positivos e que podem formar esporos) tem se destacado.
Tradicionalmente, a detecção e identificação do genêro Bacillus é rotineiramente realizado do isolamento de meios muitas das vezes sem elementos seletivos (TSA por exemplo) e após o isolamento das colônias emprega-se uma série de provas bioquímicas para a identificação. Em muitos dos casos, o conjunto de tais provas torna-se dispendioso, encarece o processo e devido o tempo de positivação de tais provas, o processo de análise se torna mais longo.
Nesta publicação, apresentamos o meio cromogênico da marca Himedia: o HiCrome™ Bacillus Agar (código M1651)!
https://www.himedialabs.com/TD/m1651.pdf
Ao invés de partir do princípio do isolamento em meios tradicionais + realização de provas bioquímicas, este meio utiliza o princípio a metabolização, por reações enzimáticas específicas, sobre os substratos cromogênicos e o produto final desta metabolização resulta em um componente visível na forma de cores e/ou emissão de fluorescência sob um comprimento de onda (λ )específico. Organismos são identificados por meio de reações enzimáticas simples específicas de suas espécies, produzindo cores visualmente distintas.
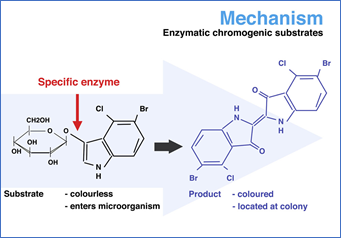
Exemplo de mecanismo de funcionamento dos meios cromogênicos
O meio HiCrome™ Bacillus Agar contem peptona, extrato de carne (aceptores de nitrogênio e aminoácidos de cadeia longa, vitaminas e outros nutrientes essenciais. O manitol na composição atua como fonte de carbono e como carboidrato fermentável onde que é detectado pela presença do vermelho de fenol no meio.
Sendo um meio específico para o gênero Bacillus o meio HiCrome™ Bacillus Agar torna-se uma excelente opção para o isolamento de Bacillus cereus em alimentos e produtos lácteos. Também é uma alternativa para o isolamento em amostras clínicas tais como pus, sangue, exudatos oculares.
Quando utilizado o meio HiCrome™ Bacillus Agar, as provas bioquímicas na maioria dos casos ficam desnecessárias pois as colorações resultantes são específicas na maioria dos casos para espécies específicas de Bacillus conforme a tabela abaixo.

FICA A DICA!!!! #1
Para o isolamento seletivo de Bacillus cereus e Bacillus thuringiensis é recomendado a adição do suplemento FD324 (Bacillus Selective Supplement). O suplemento inibe o crescimento de outras cepas de Bacillus (ex. B. subtilis, B. coagulans, B. megaterium etc.) e torna o meio mais seletivo B. cereus e B. thuringiensis.
FICA A DICA!!!! #2
É possível realizar a diferenciação de Bacillus cereus e Bacillus thuringiensis no meio HiCrome™ Bacillus Agar. B. cereus apresenta as bordas das colônias bem delimitadas e com o centro mais azulado e B. thuringiensis apresenta as bordas das colônias irregulares.
 B. cereus
B. cereus
 B. thuringiensis
B. thuringiensis
FONTES:
Dúvidas? Fale conosco:
microbiologia@exodocientifica.com.br
A HiMedia é um dos principais fornecedores de produtos químicos testados para cultura de tecidos de plantas e bioquímicos.
A gama completa de químicos testados em cultura de tecido são avaliados analiticamente em diferentes parâmetros juntamente com testes específicos nos quais são empregados nas próprias culturas de tecidos vegetais a fim de verificar sua adequação e desempenhos.
Muitos usuários preferem projetar suas próprias formulações de meios, nutrientes e hormônios, mantendo esse requisito em mente, a Himedia possui uma ampla gama de produtos químicos, incluindo macroelementos, microelementos, aminoácidos, carboidratos, vitaminas e suplementos orgânicos todos direcionados para o cultivo celular vegetal (PTC).
Todos os produtos da linha PTC da Himedia passam por um rigoroso controle de qualidade exigido para manter a consistência e a qualidade.
Dentre tais testes que diferenciam os químicos da linha PTC de químicos utilizados rotineiramente em análises são:

Aparência:
Testados parâmetros tais como cor, textura, qualidade e consistência

Solubilidade:
A solubilidade de todos os químicos PTC são avaliadas individualmente nos respectivos solventes que são solúveis.

FTIR (Espectroscopia de Infravermelho por transformada de Fourier):
Os químicos da linha PTC são submetidos a espectros de IR e comparados com seus respetivos padrões.
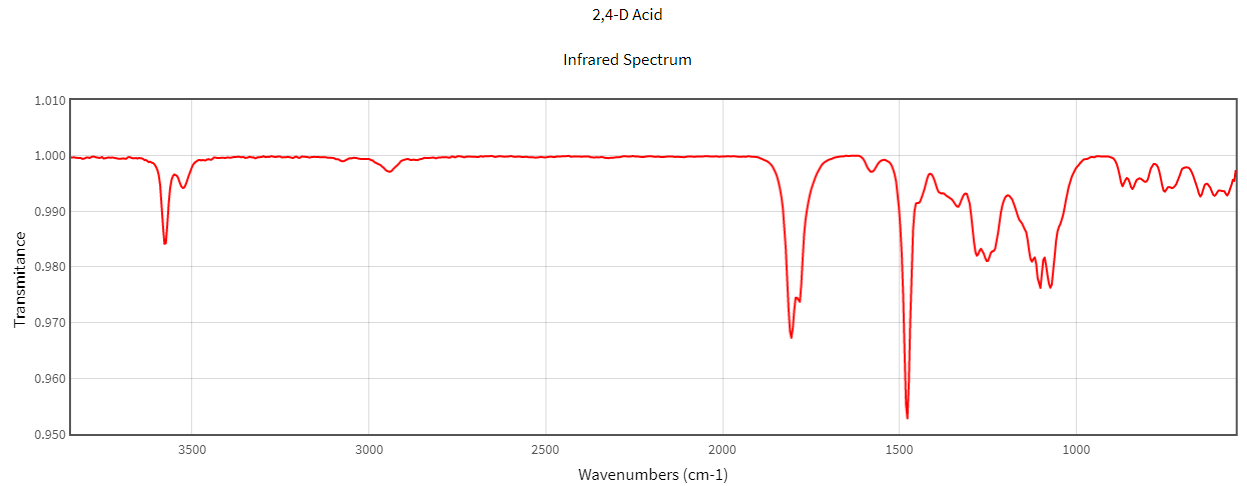
Ensaio: Medidas qualitativas e quantitativas dos analitos são realizados em diferentes tipos de ensaios que garantem o grau de pureza e teor.

Ponto de fusão: Teste usual para a determinação da pureza da amostra e a quantidade de impurezas

Testes em Cultura Celulares Vegetais: Os químicos da linha PTC são todos testados diretamente em diferentes culturas a fim de garantir o desempenho esperado e evitar problemas comumente quando se utiliza químicos não tratados na linha PTC (necroses de tecidos e não desenvolvimento


Nós da Êxodo Científica, distribuidores autorizados da Marca HiMedia no Brasil, possuímos um corpo técnico disponível sobre a linha PTC.
Quaisquer dúvidas nos contatem!
microbiologia@exodocientifica.com.br
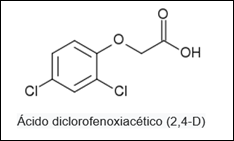
O Ácido trifluoracético, composto organofluorado de fórmula F3CO2H, possuindo uma constante de ionização pKa 0,23.
É utilizado em diferentes técnicas e reações tais como:
– Reagente amplamente utilizado em reações de síntese orgânica pois o ácido tricloroacético possui vários fatores que tornam conveniente seu uso: volatilidade (ebulição entre 72-73 °C, mais especificamente a 72.4 °C), solubilidade em solventes orgânicos e atua como um ácido forte e também é menos oxidante do que o ácido sulfúrico.
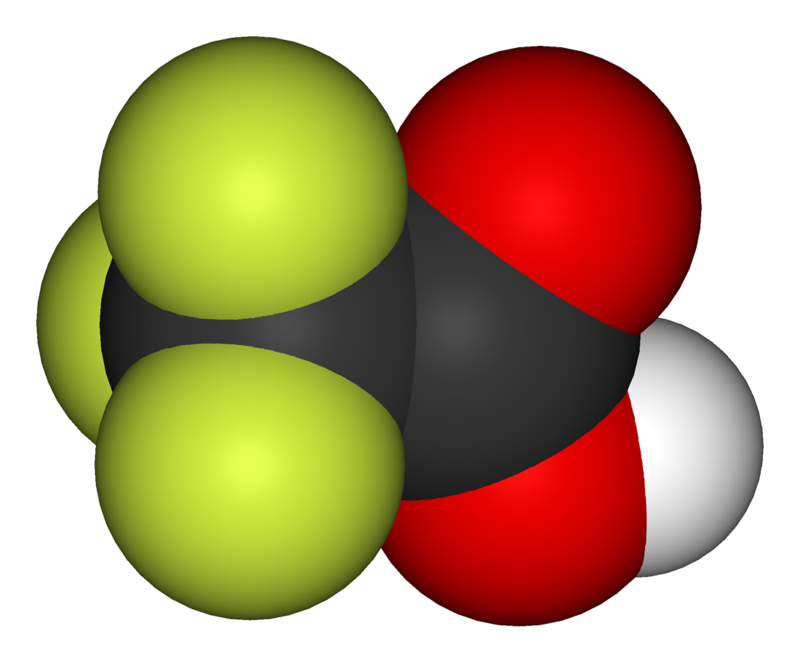
– É precursor de outros compostos organofluorados como exemplo o ácido trifluoroperacético e 2,2,2-trifluoroetaol etc.
-Em síntese de peptídeos, o Ácido Trifluoroacético é utilizado devido sua capacidade de ser um ácido forte para remover os ésteres de terc-butil ( o terc-butil juntamente com o Fmoc [fluorenilmetoxicarbonila] “protegem” os grupamentos amina, especialmente durante a síntese do próximo aminoácido da direção do N-terminal da cadeia do peptídeo).
– Em baixas concentrações, o TFA é usado como par iônico em cromatografia líquida (HPLC) de compostos orgânicos, particularmente peptídeos e pequenas proteínas (baixo peso molecular).
– Em técnicas de RMN, o ácido trifluoroacético é um solvente para materiais estáveis em ambiente ácido. Também possui aplicação como calibrador em espectrometria de massas.
-É amplamente empregado para a análise de produtos farmacêuticos tais como celmoleucin (interleucina-2), elcatonina e alfapoetina entre outros.
Nós da Exodo científico apossuímos o ácido trifluoroacético em diferentes apresentações, seja o TFA deuterado (imprescindível para análises de técnicas de RMN), TFA para espectroscopia (UV mínimo 99,8%), grau LC-MS.
Para maiores solicitações e para esclarecimento de dúvidas, nos contate!
microbiologia@exodocientifica.com.br
Um dos grandes desafios de quem trabalha com a cultura de tecidos vegetais é evitar e prevenir a contaminação microbiana. Os microrganismos que infectam as culturas de tecidos vegetais levam ao esgotamento de nutrientes no meio devido sua rápida assimilação e metabolização de tais nutrientes e reduz as chances de sobrevivência da cultura de plantas, onde em muito dos casos, quando não tratado/ remediado a tempo, pode ocorrer até a perda de toda a cultura.
Dentre estes agentes, hoje apresentamos o Phytapro ™.
Quando os contaminantes microbianos (bactérias, fungos, vírus) estão estabelecidos na cultura, eles usualmente crescem rapidamente, retirando os nutrientes do meio e em muitos casos produzindo toxinas que afetam o crescimento e que culminam na morte da cultura (muitas vezes já estabelecida).
Como solução tanto para se evitar quando para se remediar os impactos de uma contaminação, diante destes eventuais problemas, o uso PhytaPro ™ é um interessante recurso.
O PhytaPro ™ é um biocida/ fungicida de largo espectro designado para ouso em culturas de tecidos vegetais. É um conservante/biocida e estável ao calor. É biodegradável e quando utilizado na concentração correta não afeta o desenvolvimento da germinação nem a proliferação de cultura de calos.
ATENÇÃO!
O potencial dos antibióticos como agentes de seleção têm sido muito bem empregado em sistemas de transformação de plantas e nós da Exodo Científica, distribuidores autorizados da marca Himedia no Brasil, fornecemos uma ampla gama de importantes agentes seletivos incluindo antibióticos tais como higromicina B, Canamicina, timentina, neomicina e muitos outros!
© Copyright 2015 - 2024 - Êxodo Científica. Todos os direitos reservados.
Desenvolvido por Êxodo Científica