
Os produtos farmacêuticos, cosméticos, amostras tratadas com antissépticos, superfícies sanitizadas e amostras que passaram por algum tratamento com algum desinfetante, precisam de um preparo especial para poder analisar os parâmetros microbiológicos.

Tais produtos e superfícies tratadas possuem em sua composição ou apresentam resquícios de componentes com atividades antimicrobianas (que fazem parte da composição de um medicamento por exemplo ou que se encontra depositado em uma superfície tratada com algum desinfetante). Estes compostos devem ser neutralizados antes da execução dos testes, para que o crescimento microbiano não sofra interferências.
Outro fator de suma importância é ter o conhecimento das capacidades antimicrobianas dos diferentes analitos. Estas devem ser neutralizadas antes da execução dos testes, para garantir que o crescimento microbiano não seja prejudicado. Nos casos de monitoramento ambiental, é importantíssimo saber quais inibidores estejam presentes das salas classificadas do local (seja a superfície, pontos de coleta ou qualquer outro local), onde há constante uso de agentes bactericidas e bacteriostáticos.
Certos meios de cultura já possuem certos neutralizantes inseridos na sua formulação. Dentre estes, vamos citar os três mais empregados: Caldo Dey- Engley (Caldo D/E), Caldo T.A.T, Caldo Letheen.

Na publicação de hoje (PARTE I), falaremos sobre o Caldo Dey Engley
O Caldo Neutralizante Dey-Engley (D/E) é formulado de acordo com o procedimento descrito por Dey e Engley (referencia). Este meio se adequa perfeitamente para análises ambientais onde o processo de neutralização de componentes químicos presentes nas amostras sejam essenciais para a determinação da atividade bactericida e para que se possa inativar tais componentes a fim de detectar e quantificar microrganismos. A grande capacidade bacteriostática destes componentes inibem o crescimento bacteriano e impedem a capacidade reprodutiva bacteriana sem que ocorra a morte (neste estado dizemos que os microrganismos se encontram injuriados. Porém estes mesmos microrganismos tem a capacidade de causar infecções em condições favoráveis.

O caldo D/E é utilizado em diferentes testes:
I- Neutralização de Produtos Farmacêuticos
O caldo D/E da Marca Himedia (Código M1062) atende em sua composição a formulação de acordo com a Farmacopeia Brasileira 6ª Edição (2019), onde, para a maioria dos casos, o material a ser analisado é neutralizado sendo que o diluente e a amostra seguem a proporção de 10:1 e após esta etapa de neutralização o roteiro analítico é seguido de acordo com as análises a serem realizadas.

II- Avaliação da capacidade Neutralizante de Sanitizantes
Para testes que avaliam a capacidade neutralizante e a dosagem da concentração mínima para que ocorra a neutralização, deve se utilizar o Caldo Neutralizante D/E já citado (Código M1062) + o Caldo D/E Base que não possui os agentes inativantes (Código M187). Ao realizar este teste, pode se utilizar concentrações diferentes de sanitizante, onde é adicionado 1 mL de sanitizante em 9 mL de Caldo D/E e Caldo D/E Base. Aguardar 15 minutos e Inocular uma amostra bacteriana proveniente de um caldo nutritivo não seletivo (diluir a amostra bacteriana 1:100.000 e inocular 100µL desta suspensão em cada um dos tubos contendo as duas formulações do Caldo D/E. Inocular por 48 horas. Havendo crescimento no Caldo Neutralizante D/E (Código M1062) e ausência de crescimento no caldo D/E sem neutralizante indica que houve a neutralização do sanitizante ( a ausência de crescimento no tubo contendo o Caldo D/E Base indica a inibição do sanitizante). Havendo crescimento no tubo do caldo D/E Base em os inibidores indica que a concentração de sanitizante é incapaz de inibir os microrganismos.

Obs.: A visualização de crescimento bacteriano no caldo D/E é visualizado através da mudança de cor para amarelada e/ou formação de uma película na superfície do meio.
O Caldo D/E possui em sua composição Triptona que serve como fonte de nitrogênio e fonte de carbono, aminoácidos de cadeia longa, vitaminas e outros nutrientes essenciais. Dextrose é a fonte de energia. Extrato de levedura atua como um aceptor de vitaminas do complexo B.
Como agentes neutralizantes o caldo D/E fornece os seguintes inativantes que atuam sobre as classes de compostos:

O púrpura de Bromocresol adicionado na formulação é um indicador da fermentação da glicose presente no meio.
Deseja comprar esse produto? Envie um e-mail para:
contato@exodocientifica.com.br
A Cromatografia Liquida de Alta Eficiência (CLAE) ou do inglês High Performance Liquid Chromatography (HPLC), é altamente difundida e empregada em diversos e diferentes segmentos tais como industrial, farmacêutico, alimentício, pesquisa etc.
As áreas de aplicação das técnicas de HPLC vem aumentando a cada dia, conforme evidenciado por periódicos e publicações sobre o assunto. No entanto, a alta confiabilidade dos resultados pode ser atribuída apenas se materiais de alto grau de pureza forem usados, além da adesão à calibração regular e cronograma de manutenção
A fase móvel do HPLC deve ser um solvente que respeite algumas características impostas por esse método analítico. A principal característica é que a fase móvel dissolva a amostra sem qualquer interação química entre ambas. Esta fase deve ter alto grau de pureza ou ser de fácil purificação, para que se possam fazer análises de alta sensibilidade, pois as impurezas podem interferir na detecção do analito por ultravioleta (UV). A fase móvel deve ser compatível com o detector empregado e, também possuir polaridade adequada para permitir uma separação conveniente dos componentes da amostra.
A seleção de solventes para uso como fase móvel na análise de HPLC é um componente chave do desenvolvimento do método. Não é possível ter um solvente universal que atenda a todas as aplicações e muitas vezes uma combinação de solventes é necessária de acordo com os requisitos de análise. A seleção de solventes adequados é baseada em suas propriedades físicas e compatibilidades com a fase estacionária da amostra e da coluna.
Os solventes da fase móvel devem ter baixa volatilidade, especialmente para uso com detectores de espalhamento de luz. Solventes altamente voláteis podem levar a mudanças de composição da fase móvel com o uso e armazenamento. Isso pode levar a uma baixa reprodutibilidade dos cromatogramas.
Os solventes selecionados devem ter baixa viscosidade para que o fluxo através da coluna não leve ao desenvolvimento de altas contrapressões.
Os solventes selecionados devem ser inertes aos componentes da amostra, embalagem da coluna e material da coluna. Qualquer reatividade com qualquer um desses componentes pode levar à formação de precipitados, gases ou outros produtos de reação que podem prejudicar o desempenho do sistema. Os solventes não devem formar fases separadas ao entrar em contato com a amostra.
Muitas das vezes associamos todas as características citadas acima somente a solventes importados que são comumente utilizados. Nós da Exodo Científica, possuímos tais especificações e realizamos todos os testes em nossos solventes grau HPLC produzidos onde analisamos os mesmos parâmetros com o mesmo rigor em nosso controle de qualidado garantindo um desempenho satisfatório e equivalente aos meios importados. E o melhor ainda, à pronta entrega!
Segue abaixo exemplos de solventes grau HPLC que possuímos em nosso estoque À PRONTA ENTREGA!
Caso necessite de algum que não conste na lista, consulte-nos!
4-METIL-2-PENTANONA HPLC 99,5% 100ML |
ACETATO DE ETILA UV-IR-HPLC PA ACS |
ACETATO DE METILA 99,8% HPLC |
ACETONA HPLC |
ACETONITRILA HPLC |
ACETONITRILA HPLC (GRADIENTE) |
ACIDO ACETICO GLACIAL HPLC |
ACIDO DODECANOSULFONICO-1 SAL SODICO ANIDRO HPLC |
ACIDO HEPTANOSULFONATO-1 SAL SODIO H2O HPLC |
AGUA PADRAO HPLC |
ALCOOL BUTILICO NORMAL (BUTANOL-1) 99,7% HPLC |
ALCOOL ETILICO HPLC 95% |
ALCOOL ETILICO HPLC 99,9% |
ALCOOL ISO PROPILICO HPLC |
ALCOOL METILICO HPLC |
ALCOOL METILICO HPLC GRADIENTE |
ALCOOL PROPILICO NORMAL HPLC |
CICLOHEXANO HPLC |
CLOROFORMIO HPLC ESTABILIZADO COM AMILENO |
CLOROFORMIO HPLC ESTABILIZADO COM ETANOL |
DICLOROMETANO HPLC |
DIMETILFORMAMIDA-N,N HPLC |
ETER DE PETROLEO 30-60 UV/HPLC |
ETER METIL TERC-BUTILICO HPLC |
ETILMALEIMIDA-N 98% HPLC |
FOSFATO DE AMONIO MB. HPLC 1KG |
FOSFATO DE POTASSIO MB. HPLC |
HEPTANO-N HPLC 95% |
HEXANO (MISTURA DE ISOMEROS) HPLC 95% |
HEXANO (MISTURA DE ISOMEROS) HPLC 99,9% |
HEXANO-N HPLC 95% |
HEXANO-N HPLC 99% |
HIDROXIDO DE TETRABUTILAMONIO 0,4M EM H2O HPLC |
ISO OCTANO (TRIMETILPENTANO) HPLC |
METIL ETIL CETONA UV/HPLC |
PENTANO-N HPLC/UV 99% |
TETRACLOROETILENO HPLC |
TETRAHIDROFURANO HPLC |
TETRAHIDROFURANO HPLC ESTABILIZADO 99,8% |
TETRAHIDROFURANO HPLC ESTABILIZADO 99,8% 2,5L |
TOLUENO (TOLUOL) HPLC |
TOLUENO (TOLUOL) HPLC 99,5% |
TOLUENO (TOLUOL) UV-IR-HPLC-GPC PA ACS |
TRIETILAMINA HPLC |
Os coliformes, tem sido utilizados como indicadores da qualidade da água (através do princípio que estes microrganismos estarem presentes no intestino de animais de sangue quente e a presença de bactérias que fazem parte do grupo coliformes é um indicador que a fonte de água possui contaminação fecal recente).
Historicamente, o grupo coliforme é definido como microrganismos que possuem a capacidade de fermentação da lactose.
Diferentes estratégias foram desenvolvidas para o exame bacteriológico da água visando a detecção do grupo coliforme. Um dos primeiros métodos para a detecção de coliformes em amostras de água pela técnica de tubos múltiplos foi a técnica fazendo o uso do Caldo Lauril Caldo /Verde brilhante/Caldo EC
O teste de presença/ausência (PA) para o grupo de coliformes é uma modificação simples dos procedimentos de tubos múltiplos e fornece uma estimativa qualitativa e quantitiativa de coliformes. Este teste é destinado
para uso em amostras de rotina coletadas do sistema de distribuição ou estações de tratamento de água. O caldo PA maximiza a detecção de coliformes quando presentes em amostras contendo muitos outros organismos que poderiam suprimir ou crescer excessivamente e inibir o resultado que pode causar problemas de detecção.
Posteriormente, Weiss e Hunter propuseram uma simplificação do procedimento para o exame bacteriológico da água. O teste PA (Presença / Ausência) foi desenvolvido como uma versão simplificada com base no princípio de que coliformes e outros indicadores bacterianos contaminantes não ser possam ser encontrados com o emprego das técnicas tradicionais.
Outros aspectos do caldo PA foram estudados por Clark et al. O que fez com que este meio se tornou uma metodologia bastante utilizada e foi inscrito no Standard Methods for the Examination of Water and Wastewater para atender tanto a quantificação (através de tubos múltiplos) quanto averiguar a ausência de coliformes em uma amostra (Presença/Ausência).
O Caldo P/A contem digesto péptico animal, triptose, extrato de carne suplementado com fatores de crescimento e traços nutrientes que favorece o desenvolvimento dos coliformes. Lactose é o carboidrato fermentado e fonte de energia para o metabolismo bacteriano. Fosfatos constituem o sistema tampão. Purpura de bromocresol é o indicador de pH. A maioria dos fermentadores de lactose produz ácido e gás. O meio utilizado com força tripla pode ser utilizado para analisar diretamente amostras de 100mL sem a necessidade de aliquotar frações para a realização de tubos múltiplos (Assim se obtém somente o resultado de presença e ausência e não quantificação. Para a quantificação, utiliza-se da técnica dos tubos múltiplos)
O resultado do meio caldo PA é presuntivo. No caso de positivação da amostra, deve-se realizar testes confirmatórios como o uso do caldo lactose (M026) .
Nós da Exodo Científica, distribuidores autorizados da marca Himedia no Brasil, possuímos este e muitos outros meios à pronta entrega! Consulte-nos para mais informações!
contato@exodocientifica.com.br
A cromatografia de troca iônica conhecida como cromatografia de íons (CI), enquanto a cromatografia de par iônico e a cromatografia por exclusão iônica são consideradas como sendo aplicações mais específicas.
A cromatografia de troca iônica (CI) é baseada em uma reação química estequiométrica entre os íons de uma solução e uma substância sólida (resina) contendo os grupos funcionais que podem fixar íons como resultado de forças eletrostáticas. No caso mais simples, em cromatografia de cátions, são grupos de ácido sulfônico; em cromatografia de ânions, são grupos de amônio quaternário. Teoricamente, íons com a mesma carga podem ser completa e reversivelmente trocados entre as duas fases. O processo de troca iônica leva a uma condição de equilíbrio. O lado em que ocorre o equilíbrio depende da interação de íons participantes em relação aos grupos funcionais da fase estacionária.

A cromatografia por par iônico é uma versão de alto desempenho da cromatografia por troca iônica. Essa técnica é aplicada na separação de amostras iônicas utilizando uma fase estacionária reversa. Neste mecanismo de separação, o pH da fase móvel é ajustado de modo a promover a ionização dos componentes da amostra. Adiciona-se o reagente par iônico, normalmente surfactantes com cargas opostas aos analitos a serem separados, para formação de um par iônico de carga neutra entre o analito e o surfactante. O par iônico neutro ao entrar em contato com a fase estacionária reversa, fica adsorvido devido à interação que ocorre entre a fase estacionária (apolar) e a cauda alifática presente no surfactante, proporcionando a separação.
A cromatografia de par iônico é mais complexa que a cromatografia em fase reversa, pois o equilíbrio entre o surfactante e a fase estacionária é lento, a separação é mais sensível às variações de temperatura e de pH.

Como exemplos de reagente par-iônico podem ser citados: ácido heptafluorobutírico (HFBA), ácido tridecafluorohelptanóico (TDFHA), ácido perfluoropentanóico (NPFA), entre outros.
O HFBA é um ácido carboxílico fluorado, muito utilizado como pareador iônico por promover a separação de analitos polares utilizando fase estacionária reversa e permitir detecção por espectrometria de massas por ser suficientemente volátil.

O mecanismo de separação dominante em cromatografia de par iônico é a adsorção. A fase estacionária é constituída, por exemplo, por uma resina neutra de divinilbenzeno poroso de baixa polaridade e alta área superficial específica. Fases estacionárias de octadecil silica, quimicamente ligadas, com polaridade menores também podem ser usadas. A seletividade da coluna é dada pela fase móvel. Além de um modificador orgânico, o PAR IÔNICO é adicionado ao eluente (água, solução aquosa tamponada etc.) dependendo da natureza química. Este tipo de cromatografia é particularmente adequado para separação de ânions de superfícies ativas, compostos de enxofre, aminas e complexos de metais de transição.

Nós da Êxodo Científica possuímos à pronta entrega reagentes para a realização da cromatografia de par Iônico! Para mais informações consulte a nossa equipe!

COMPRE AGORA:
contato@exodocientifica.com.br
Referências:
– Gustavo Silveira; César Ricardo Teixeira Tarley. Quím. Nova v.31 n.7 São Paulo 2008
– R. Gloor, E.L. Johnson Practical Aspects off Reverse Phase Ion Pair Chromatography Journal of Chromatographic Science, Volume 15, Issue 9, 1977.
– Curt Pettersson; Göran Schill A Separation of enantiomeric amines by ion-pair chromatography Author links open overlay panel. Journal of Chromatography A Volume 204, 16 January 1981, Pages 179-183 Journal of Chromatography
Meio Ácido Fólico Casei (para o ensaio microbiológico de ácido fólico no soro sanguíneo ) à pronta entrega!
O Meio Folic Acid Casei é utilizado em ensaios para a quantificação de ácido fólico em amostras de soro, fazendo uso de Lactobacillus casei ATCC 7469 como o organismo de teste.
O ácido fólico também chamado de folacina, ácido pteroil-L-glutâmico ou Vitamina B9 atua na prevenção de anomalias congênitas no primeiro trimestre da gestação resultantes do desenvolvimento do tubo neural, que entre os dias 18 e 26 do período embrionário transforma-se na espinha. Defeitos do tubo neural são malformações que ocorrem no início do desenvolvimento fetal, sendo os principais a anencefalia e espinha bífida. A dose diária recomendada é de 600 mcg no período de no mínimo um mês antes da concepção até três meses ou 12 semanas de gravidez (1º trimestre).
Pessoas normais possuem um nível de ácido fólico de 9,9 ng/mL. Existem alteração destes níveis em certas anormalidades e patologias.
O Meio Ácido Fólico Casei É utilizado para o ensaio microbiológico de ácido fólico no soro usando a cepa padrão de Lactobacillus casei ATCC 7469 Como microrganismo teste. Este meio possui a formulação estabelecida por Flynn, modificado por Baker e Waters e Mollin.
Para a realização deste (e demais testes envolvendo ensaios de vitaminas) é necessário o emprego de 3 meios distintos (um para a manutenção da cultura do microrganismo, um meio para inoculação e um meio para realização dos testes). Este terceiro meio geralmente é um meio definido quimicamente que contém todos os ingredientes e nutrientes essenciais para o crescimento dos organismos o qual será adicionado o material a ser analisado.
Da mesma forma, o Meio Folic Acid Casei contém todos os nutrientes essenciais para o crescimento de L. casei, exceto o ácido fólico. Portanto, a adição de ácido fólico em concentrações crescentes especificadas no Meio Folic Acid Casei especificadas garante um aumento na resposta de crescimento de L. casei que em concentrações conhecidas é utilizado como referência para a determinação de uma curva padrão.
Técnica:
I- Preparo e manutenção das cepas de Lactobacillus casei ATCC 7469
-A cultura estoque de Lactobacillus casei ATCC 7469 são cultivadas por punção em tubos de ensaio no Lactobacilli Agar AOAC (M366). Incubar a 35ºC-37ºC por 18h-24h. Após este período manter os tubos armazenados em geladeira. Repicar para outro meio Lactobacilli Agar AOAC (M366) mensalmente para a manutenção da cultura.
II- Teste
– O inóculo para o ensaio é preparado através da subcultura obtida anteriormente (Lactobacillus casei ATCC 7469), desta vez as cepas no meio de estoque são inoculadas em um tubo contendo 10mL do meio Micro Vitamin Test Inoculum Broth (M133) ou Lactobacilli Broth (M367) por 24 horas a 35-37°C. Esta suspensão bacteriana é centrifugada em condições assépticas , o sobrenadante é descartado. As células são ressuspendidas em 10ml
do Meio Ácido Fólico Casei, ressedimentado (centrifugado novamente) e lavado mais uma vez. Finalmente o lavado celular é ressupendido em 10mL do Meio Ácido Fólico Casei (concentração simples). Diluir esta suspensão 1:100 com o mesmo meio. Uma gota desta suspensão é usada para inocular cada tubo de ensaio.
Uma curva padrão para cada ensaio deve ser realizada utilizando ácido fólico nas seguintes concentrações: (0 / 0,1/ 0,2/ 0,4/ 0,6/ 0,8 e 1ng).
*Preparar o acido fólico diluindo em etanol.
III- Preservação do soro
Dispensar 5 mL do soro em tubos e adicionar 25mg de ácido ascórbico em cada tubo. Manter armazenado em -20°C até realização do ensaio.
IV- Preparação das amostras
Do soro preservado com ácido ascórbico, adicionar 5 mL desta amostra em 45mL do meio Tampão Ácido Fólico (M544). Incubar a mistura de soro mais solução tampão a 37°C por 90 minutos. Autoclavar a 121°C por 2,5min. Remover o coágulo de proteína formado (centrifugar a amostra e retirar o sobrenadante para os testes).
V- Procedimento para a determinação de ácido fólico total
Usar 0,5mL, 1,0mL e 1,5mL ou outros volumes do preparado de soro determinado em IV. Colocar em cada tubo de ensaio 5mL do meio Meio Folic Acid Casei e água destilada suficiente para atingir um volume de 10 mL por tubo. Esterilizar os tubos por 5min. Resfriar imediatamente em banho de gelo. Adicionar 1 gota da suspensão de Lactobacillus casei ATCC 7469 conforme preparada em II em cada tubo. Incubar por 18-24horas. Após este período, antes de iniciar a leitura dos testes, resfriar por 15-30 minutos para inibir o crescimento bacteriano.
A leitura é realizada a λ=620nm. A quantidade de ácido fólico na amostra é determinado através dos valores obtidos com a curva padrão considerando a diluição da amostra.
Fica a dica!
Sempre usar tubos que sejam livres de detergentes! Mesmo em quantidades baixíssimas de detergente, este pode levar a resultados errôneos.
Sempre utilizar tubos esterilizados para evitar possíveis contaminações no decorrer da realização dos testes.
Materiais como suspensões coloidais, emulsões, espumas, géis e materiais granulares apenas fluem irreversivelmente quando um limite de tensão de cisalhamento finito (chamado de tensão de escoamento)é excedido.
Carbopol® é uma marca comercial de propriedade da Lubrizol Corporation (Wickliffe, OH, EUA).
Carbopol® é uma família de polímeros comerciais frequentemente empregados na indústria de cosméticos, farmacêutica, tintas e alimentos como um agente de espessamento, suspensão, dispersão e estabilização.
Em ambientes de pesquisa as soluções são frequentemente empregados em experimentos de visualização de fluxo, pois são géis transparentes de fácil e rápido preparo.
Existem mais de 10 graus de polímeros de Carbopol, que podem ser subdivididos em várias categorias com base em sua estrutura física e composição química, densidade de reticulação, polimerização solvente, tipo de reticulação, carga elétrica da rede e aparência física.
Carbopol é um polímero de ácido poliacrílico de alto peso molecular, hidrofílico e reticulado. Este hidrogel físico apresenta uma rede de polímero tridimensional que é dilatada pela água, e apresenta reversibilidade temporária e emaranhados entre cadeias que são mais resistentes quando comparados aos hidrogeis químicos.
O Carbopol NF 980, é citado na Farmacopeia Americana (USP) em monografia. Na USP é chamado de Carbomer Homopolymer Type C (antigo Carbomer 940) (USP / NF).
Carbopol NF 980 é um homopolímero sintético, ácido poliacrílico reticulado com alil sacarose ou alil pentaeritritol, que é polimerizado em um sistema de co-solvente. É fornecido
como um pó branco e seco de partículas primárias com média de 0,2 µm de diâmetro. É um polímero polieletrólito aniônico fraco que deve ser neutralizado para atingir uma alta viscosidade. Cada partícula (ou estrutura da trama de rede) é uma mistura de cadeias poliméricas lineares fortemente enoveladas, que são solúveis em solventes. A viscosidade das soluções de Carbopol 980 não é função do tamanho de suas partículas de pó. É bem conhecido que este polímero forma uma dispersão coloidal quando hidratado em água em pH e temperatura adequadas. Frequentemente, uma dispersão aquosa de Carbopol é neutralizada com uma base comum, como
hidróxido de sódio (NaOH), convertendo o polímero ácido em um sal. Quando neutralizado, o polímero apresenta a capacidade de absorver e reter água. Cadeias de polímero interconectadas por ligações cruzadas começam a hidratar e desenovelar parcialmente devido à repulsão eletrostática para formar aglomerados irreversíveis. A natureza do limite de elasticidade desejada é devido à presença de cadeias ramificadas de poliacrilato de alto peso molecular que formam “enredamentos” inter-cadeias que impedem o fluxo em baixas tensões de cisalhamento (tensão de escoamento). Durante a hidratação as cadeias podem aumentar em até 10 vezes seu diâmetro original, e o processo de ionização leva a uma ligação cruzada das moléculas inchadas, formando uma rede de microgel com ligações mais fortes
A dispersão de Carbopol apresenta comportamento diferente dependendo do solvente. Em geral, a água é usado como solvente. No entanto, co-solventes e sistemas anidros também têm sido usados. Etanol e isopropanol podem ser espessados adicionando polímeros de Carbopol. Neste caso, é crucial usar o apropriado neutralizador, que varia dependendo do teor de álcool. Além disso, trabalhos anteriores já demonstraram a possibilidade de formular sistemas Carbopol usando diferentes solventes hidrofílicos, como polietilenoglicol (PEG) 400, glicerol, silicone e tetraglicol sem neutralização.
Referências:
Gutowski, I.A.; Lee, D.; de Bruyn, J.R. Scaling and mesostructure of Carbopol dispersions. Rheol. Acta 2012, 51, 441–450
Putz, A.; Burghelea, T. The solid-fluid transition in a yield stress shear thinning physical gel. Rheol. Acta 2009, 48, 673–689.
Taylor, N.W.; Bagley, E.B. Dispersions or Solutions? A Mechanism for Certain Thickening Agents. J. Appl. Polym. Sci. 1974, 18, 2747–2761
Chu, J.S.; Yu, D.M.; Amidon, G.L.; Weiner, N.D.; Goldberg, A.H. Viscoelastic Properties of Polyacrylic Acid Gels in Mixed Solvents. Pharm. Res. 1992, 9, 1659–1663.
MAPA IN nº60 de 2018!
ALIMENTOS , ANÁLISES CLÍNICAS, AMBIENTAL, PRODUTOS LÁCTEOS.
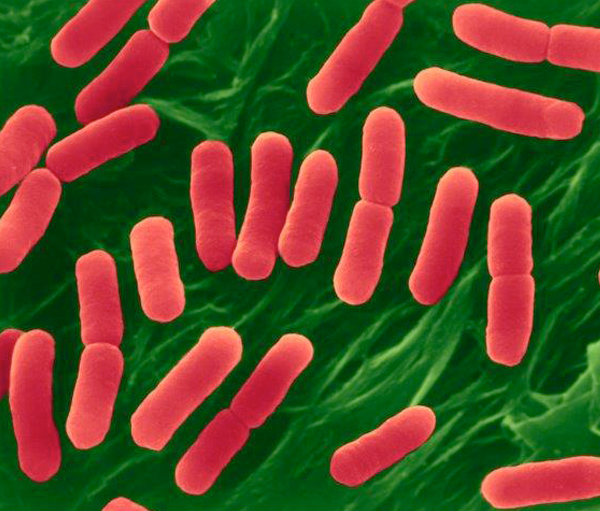
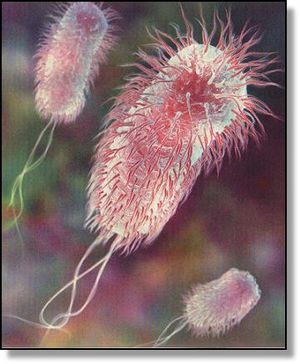
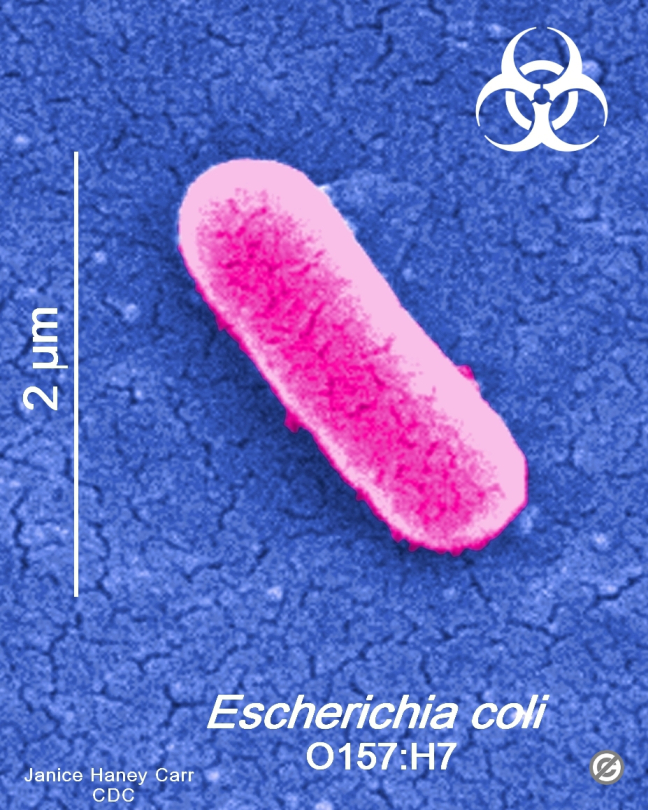
Recentemente o Ministério da Agricultura, Pecuária e Abastecimento (MAPA) através da Instrução Normativa Nº 60 de 2018, torna obrigatório o controle microbiológico em carcaça de suínos e em carcaça e carne de bovinos em abatedouros frigoríficos, registrados no Departamento de Inspeção de Produtos de Origem Animal (DIPOA), com objetivo de avaliar a higiene do processo e reduzir a prevalência de agentes patogênicos.
Dentre os patógenos, ficou estabelecido a pesquisa de: Enterobacteriaceae e Salmonella spp. em carcaça de suínos; Enterobacteriaceae e Salmonella spp. em carcaça de bovinos; Escherichia coli produtora de Shiga toxina, (STEC) em carne de bovinos;
Enterobacteriaceae e Salmonella spp eram microrganismos rotineiramente pesquisados em várias fontes de materiais até então. Na legislação Brasileira, foi a primeira vez que Escherichia coli produtora de Shiga toxina se tornou obrigatório!
Escherichia coli O157:H7 pertece ao grupo de entero hemorrágicas Escherichia coli (EHEC) e predomina como um patógeno de origem alimentar.
As cepas entero hemorrágicas de E. coli são também denominadas E. coli produtoras de verocitotoxinas (VTEC / EHEC). Embora muitos sorotipos diferentes de Escherichia coli são conhecidos por produzir verocitotoxinas, as Escherichia coli O157: H7 e O157: H são até agora os tipos mais comuns que causam infecções humanas. Nos últimos anos, Escherichia coli O157: H7, vem ganhando notoriedade mundial , pois a mesma está envolvida em graves e severos surtos alimentares cada vez mais constantes.
Nesta publicação iremos tratar sobre a metodologia para isolamento de Escherichia coli O157: H7 fazendo uso do enriquecimento seletivo (realizado em caldo cromogênico) e do plaqueamento fazendo uso de meio de cultura cromogênico. Esta técnica se adequa em diferentes materiais tais como: carcaças, alimentos, amostras clínicas, produtos lácteos e amostras ambientais.
Para o enriquecimento seletivo, o material é incubado no caldo HiCrome™ Enrichment Broth Base for EC 0157:H7 (M1598).
Este meio possui triptona que fornece nitrogênio, compostos de carbono, aminoácidos de cadeia longa e outros nutrientes essenciais para o desenvolvimento de cepas de E. coli O157:H7. Sorbitol é o açúcar presente no meio (cepas Escherichia coli O157:H7 fermentam a lactose, mas não fermentam o sorbitol [em sua maioria]). A presença de sais biliares inibem o crescimento de gram positivas. A adição de telurito (Suplemento FD230) torna o meio muito mais seletivo (a presença de telurito de potássio no meio inibe o desenvolvimento de cepas de E. coli não patogênicas, presentes na flora intestinal o que torna seu uso muito atrativo para amostras clínicas ). Quando não adicionado o suplemento FD230, cepas de E. coli não patogênicas (como exemplo as presentes na flora intestinal), faz comque o meio mude para a coloração azulada.
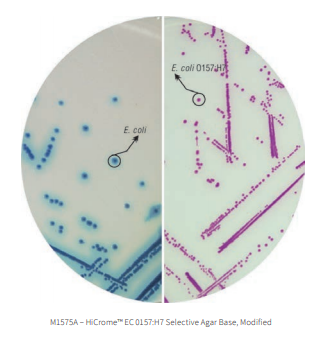
Contudo, quando presente, E. coli O157:H7 transforma a coloração do meio para ROXO (resultante da ausencia da atividade de ß-glucoronidase e da incapacidade de fermentar o sorbitol).
Esta fase de pré-enriquecimento deve ser realizada a 35-37°C por 18-24 horas.

Este meio tem uma aplicabilidade muito grande, pois pode ser utilizado não somente como meio suplementar ao MacConkey com Sorbitol (se adequa perfeitamente como 2º meio de escolha referente ISO 16654:2001), como possui um desempenho superior ao próprio MacConkey com Sorbitol (que por sua vez não detecta cepas de E. coli O157 que fermentam este mesmo carboidrato) este meio baseia na clivagem de substratos cromogênicos específicos para E. coli O 157.
O meio HiCrome™ EC 0157:H7 Selective Agar Base, Modified (M1575A) contém sorbitol e uma mistura cromogênica específica em vez de lactose e corantes indicadores, respectivamente. O substrato cromogênico presente no meio é metabolizado específica e seletivamente por Escherichia coli O157: H7 (as cepas de E. coli O157:H7 resultam em uma coloração púrpura a magenta. As estirpes de E. coli que não são produtoras de toxina resultam em colônias de coloração verde azulada)
O meio HiCrome™ EC 0157:H7 Selective Agar Base, Modified ( M1575A) possui em sua composição triptona e extrato de levedura como sendo fornecem carbono, nitrogênio e nutrientes. A presença do suplemento HiCrome™ EC O157:H7 Selective Supplement (FD187) torna o meio seletivo. O telurito de Potássio inibe seletivamente as espécies Aeromonas e Providencia (o que ajuda por sua vez sua aplicabilidade em amostras ambientais) . Novobiocina inibe bactérias gram-positivas. Lauril sulfato de sódio ajuda a inibir a flora gram-positiva presente no material.
Quando utilizado o caldo HiCrome™ Enrichment Broth Base for EC 0157:H7 (M1598) e o meio alterar de cor para ROXO, estriar uma alçada no meio HiCrome™ EC 0157:H7 Selective Agar Base, Modified (M1575A).
Incubar a 35-37°C por 18-24 horas.
Na presença do desenvolvimento de colônias magentas a rosas, realizar a sorologia mediante anticorpos do sorotipo de E. coli O157.
Nós da Exodo Científica, somos distribuidores autorizados da Marca Himedia no Brasil. Possuímos à pronta entrega todos os meios citados para o isolamento seletivo e identificação de Escherichia coli produtoras de toxina.
Consulte-nos sobre os meios de cultura, suplementos e muito mais!
microbiologia@exodocientifica.com.br
O Alginato é um polissacarídeo natural extraído de algas marrons, trata-se de um polissacarídeo, mais especificamente um poliuronídeo, formado por dois monômeros de base, β-D-manuronila e α-L-guluronila, que possui ligações glicosídicas entre seus carbonos de número 1 e 4. O alginato proveniente das algas são encontrados principalmente sob forma de sais
O alginato de sódio é comumente empregado na indústria de alimentícia para modificar as propriedades dos alimentos, como reologia (espessamento), capacidade de ligação de água, emulsão estabilizadora e formação de filme. O alginato também é capaz de formar gel por reticulação iônica. Uma das formas mais comuns é o gel de alginato na forma de partículas.
O tamanho (diâmetro) das partículas de gel de alginato possuem tipicamente faixa de> 1 mm (macro), 0,2 a 1.000 mm (micro) e <0,2 mm mm (nano). Essas partículas de gel normalmente retém alto teor de água.
Como ingrediente natural, as partículas de gel de alginato se tornam bem atraentes para aplicações biológicas, pois são biocompatíveis, não tóxicos e biodegradáveis .
Até o momento, a principal aplicação dos géis de alginato particulados pode ser encontrada no encapsulamento de materiais alimentícios, farmacêuticos, biomédicos e agrícolas. Vários ingredientes alimentares foram encapsulados ao longo dos anos. Esses ingredientes alimentares incluem óleos / lipídios, células probióticas , aromatizantes, polifenóis, vitaminas, antioxidantes, peptídeos, enzimas, etc.
A estrutura da matriz de gel bloqueia em os materiais do núcleo e formam uma barreira protetora que limita a difusão das moléculas com base em seu tamanho e cargas, ou minimiza a degradação dos materiais do núcleo sensíveis devido condições do ambiente externo.
Micrografia de transmissão eletrônica mostrando proteína de caseinato de sódio (setas amarelas) aderidas na superfície de um microgel de alginato (Ching et. al., 2014).
A aplicação de partículas de gel de alginato abrange uma ampla gama de segmentos, tais como alimentos, microbiologia, farmacêutica e medicina. Cada um destes segmentos levou a um desenvolvimento de métodos para a produção de partículas de gel de alginato para atender a cada aplicação pretendida.
Nós da Exodo Científica possuímos Alginato de Sódio à Prona entrega. Consulte-nos sobre este e muitos outros reagentes e soluções !
Referências:
Salmonellae (plural de Salmonella) constituem um dos grupos taxonômicos mais complexos dentre as Enterobacteriaceae. Em humanos as infecções por Salmonella são mais comumente causada por ingestão de alimentos, água ou produtos lácteos contaminados por excretas humanas ou animais.
Dentre os meios destinados para o isolamento para Salmonella, hoje falaremos do meio Hektoen
O Agar Hektoen Entérico foi desenvolvido em 1967 por King e Metzger no Instituto Hektoen (EUA), com o intuito de aumentar a frequência de isolados de Shigella e Salmonella em comparação com outros meios de cultura empregados para a recuperação dos mesmos microrganismos, frequentemente isolados em amostras clínicas.
O Agar Hektoen Entérico possui em sua composição a eliminação do deoxicolato de sódio e a redução da quantidade de sais biliares. Estas alterações que diferem do meio original acabam por favorecer ainda mais o crescimento tanto de Shigella quanto Salmonella. Este meio possui uma concentração mais elevada de peptonas e de carboidratos a com a finalidade de contrapor os efeitos inibitórios dos sais biliares enquanto inibe a flora microbiana intestinal acompanhante.
O Hektoen acaba sendo um dos meios mais recomendados para a cultura de Enterobacteriaceae proveniente de amostras fecais.
O meio possui 3 açúcares distintos (lactose, sacarose e salicina) que ajudam na diferenciação de patógenos entéricos. Uma concentração mais elevada de lactose auxilia na visualização de patógenos entéricos e minimiza o problema da fermentação de lactose tardia. A salicilina é fermentada por alguns coliformes incluindo aqueles que não fermentam a lactose e lactose. A combinação de amônio ferro citrato e tiossulfato de sódio no meio torna-o capaz de detectar a produção de H2S, assim, levando a diferenciação de colônias com centros negros.
A presença de um complexo de indicadores (constituído por fucsina ácida e azul de bromotimol) possui baixa toxicidade em comparação com outros meios entéricos, resultando no aumento da recuperação de patógenos entéricos.
Hoben et al (1) demonstraram um aumento da seletividade adicionando novobiocina na concentração de 15mg/L (esta suplementação inibe Proteus e Citrobacter). Thaylor e Schellaut (2) que relataram a propriedade do meio Hektoen em diferenciar patógenos entéricos e favorecer o desenvolvimento melhor de Shigella.
O meio Hektoen é recomendado em diferentes metodologias, por exemplo a ISO 6579 (pode ser utilizado como um segundo meio de escolha conjuntamente com o XLD), Compendium of Methods for the Microbiological Examination of Foods, Standard Methods for the Microbiological Examination of Dairy Products, FDA Bacteriological Analytical Manual (BAM), Standard Methods for the Examination of Water and Wastewater, ANVISA, USP, entre outros.
Para obter maiores informações, consulte-nos. Possuímos uma equipe técnico-científica de prontidão para lhe atender. Possuímos uma gama de produtos destinado às análises microbiológicas em todos os setores!
Entre em contato: microbiologia@exodocientifica.com.br
Referências:
© Copyright 2015 - 2024 - Êxodo Científica. Todos os direitos reservados.
Desenvolvido por Êxodo Científica